[Kimia Organik 3] Kekuatan Asam dan Basa dalam Kimia Organik
Keasaman senyawa organik meliputi:
- Efek resonansi
Gugus hidroksil adalah suatu gugus
fungsi asam yang dipengaruhi dengan kuat oleh substituennya. keberadaan
gugus-gugus seperti C=O atau SO2 di sampingnya akan sangat melemahkan ikatan
O-H terhadap heterolisis.Peristiwa ini biasa dinamakan dengan efek resonansi.
Pergeseran pasangan elektron bebas
oksigen yang diikuti dengan pergeseran elektron ikatan-p ke oksigen yang lain
dalam struktur resonansi 1 menghasilkan struktur resonansi 2.
Munculnya muatan positif pada atom oksigen dalam struktur 2 akan
melemahkan ikatan O-H, dan pelepasan H+ akan menghilangkan muatan tersebut.
2. Efek induksi
Efek Induksi mempengaruhi keasaman
ari suatu senyawa. Dimana Suatu efek yang dihasilkan dari penarikan elektron
dari pusat muatan negatif adalah suatu efek penstabilan karena menyebarkan
muatan sehingga menurunkan kerapatannya. Dengan demikian, gugus –I meningkatkan
keasaman asam tak bermuatan seperti asetat karena menyebarkan muatan negatif
anionnya.
Gugus –I juga meningkatkan
keasaman asam bermuatan. Sebagai contoh, jika asam bermuatan +1 (dan basa
konjugasinya adalah basa tak bermuatan), gugus –I mendestabilkan pusat
positif (dengan meningkatkan muatan positif) asam, dan destabilisasi akan
hilang ketika proton terlepas. Pada umumnya dapat dikatakan bahwa gugus yang
menarik elektron melalui efek medan akan meningkatkan keasaman dan menurunkan
kebasaan, sedangkan gugus pendorong elektron akan bertindak ke arah sebaliknya.
Sebagai contoh :
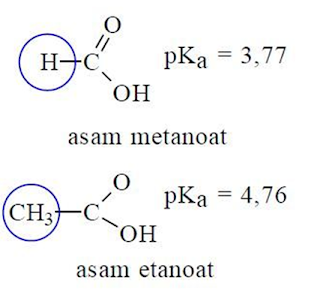
Kekuatan asam metanoat berbeda
dengan kekuatan asam etanoat, asam metanoat lebih kuat. Jika dilihat dari
struktur kedua asam di atas, dapat diperkirakan perbedaan kekuatan asam
tersebut disebabkan oleh pengaruh gugus – CH3. Dibandingkan asam
metanoat, kekuatan asam etanoat lebih lemah. Gugus –CH3 pada asam
etanoat mempunyai kemampuan mendorong elektron ikatan melalui ikatan sigma
(C-C-O-H) sehingga atom O menjadi relatif negatif, akibatnya atom H sukar lepas
sebagai H+, asamnya menjadi lebih lemah. Gugus –CH3 dikatakan
mempunyai efek induksi mendorong elektron dan diberi simbol +I.
Kebasaan Senyawa Organik
Kebasaan suatu senyawa tergantung
pada kesedian pasangan elektronnya untuk disumbangkan. Heteroatom tetangga yang
mempunyai pasangan elektron bebas seperti oksigen, nitrogen, atau halogen
cenderung melemahkan kebasaan. Sebagai contoh, hidrazin (NH2NH2)
mempunyai pKɑ yang lebih kecil sebanyak dua satuan daripada pKɑ
amoniak.
Efek induksi yang mempengaruhi
kebasaan suatu senyawa. Kekuatan basa dapat ditinjau dari kemampuan
molekul/senyawa untuk mendonorkan pasangan elektron bebasnya. Sebagai contoh
yaitu Kebasaan amoniak dan metil amonia
Kebasaan amoniak dan metil amonia
dapat berbeda karena adanya efek induksi dari gugus –CH3. Dilihat dari kekuatan
basanya, metil amina lebih kuat (pKb-nya lebih kecil). Hal tersebut dikarenakan
pada metil amina terdapat gugus –CH3. Gugus –CH3
mempunyai efek induksi mendorong elektron sehingga pasangan elektron bebas pada
atom N lebih mudah didonorkan. Akibatnya kebasaan metil amina lebih kuat
dibandingkan amonia.
Kemudahan reaksi asam basa terjadi tergantung pada kekuatan asam dan
basa. Asam dan basa kuat umumnya lebih reaktif daripada asam dan basa
lemah. Namun arah reaksi dan stabilitas produk sering tergantung pada
kualitas lain, yaitu kekerasan atau kelembutan asam atau basa.Asam
memiliki orbital kosong dan cangkang kosong tidak terisi sedangkan basa
memiliki cangkang valensi sepasang elektron tidak terikat yang bisa
disumbangkan. Berikut merupakan penjelasan mengenai asam keras, asam
lembut, basa keras, dan basa lembut.
- Asam lembut, untuk asam lunak atom akseptor pasangan elektron berukuran besar, memiliki kerapatan muatan positif yang rendah, dan mengandung pasangan elektron yang tidak terbagi dalam cangkang valensi mereka. asam lunak memiliki polarisasi yang tinggi dan elektronegativitas yang rendah. Dalam kimia organik asam lunak biasanya hanya mencakup senyawa halogen,fosfor, dan sulfur. Polarisasi artinya kemampuan suatu atom untuk memiliki distribusi elektron yang terdistorsi.
- Asam keras, Untuk asam keras, atom akseptor kecil, memiliki kecepatan muatan positif yang tinggi, dan tidak mengandung pasangan elektron yang tidak terbagi dalam cangkang valensi mereka. memiliki polarisasi yang rendah dan elektronegativitas yang tinggi. Ion hidrogen adalah contoh asam keras yang baik.
- Untuk basa lembut, basa lunak memiliki polarisasi yang tinggi, kepadatan muatan negatif rendah dan elektronegativitas rendah. basa lunak contohnya adalah ion sianida, dan iodida
- Basa keras, untuk basa keras, atom donor berukuran kecil, memiliki kerapatan muatan negatif yang tinggi dan memegang elektron valensi dengan kencang. Memiliki polarisasi yang rendah dan elektronegativitas yang tinggi. ion Hidroksida adalah contoh basa keras.
kekuatan relatif pasangan asam-basa konjugat, seperti yang ditunjukkan oleh konstanta ionisasi mereka dalam larutan air.
Berikut ini adalah gambar yang menunjukkan kekuatan relatif pasangan asam-basa konjugat
Kekuatan asam atau basa ini dapat kita tinjau dari nilai Ka (tetapan ionisasi asam) atau Kb (tetapan ionisasi basa) dari asam/basa Bronsted Lowry.bila sudah kita ketahui maka kita dapat menentukan mana asam yang relatif kuat dan sebalikya dan manakah basa yang lebih kuat dan sebaliknya. Semakin besar Ka artinya asam tersebut lebih banyak yang terurai, [H+] semakin besar pula. Ingat persamaan kesetimbangan asam basa.

Asam organik merupakan asam yang dapat diperoleh secara alami dari hewan dan tumbuhan. Ciri-ciri asam organik memiliki atom karbon (C). Contohnya asam formiat, asam asetat, asam malat, asam tartarat, asam butirat, asam sitrat, asam askorbat. Contoh dari basa organik yaitu piridin, senyawa amina.
Asam anorganik adalah asam yang tidak berasal dari makhluk hidup dan berasal dari berbagai bahan mineral. Contohnya asam sulfat, asam klorida, asam nitrat, asam fosfat. Contoh dari basa anorganik yaitu NaOH, KOH, Ca(OH)₂.
Perbedaan kekuatan asam, ada beberapa faktor yang harus diperhatikan, ada 2 faktor yang mempengaruhi ionisasi dari asam adalah kekuatan dari ikatan yang yang diputuskan dan kestabilan ion yang terbentuk.
Reaksi reaksi dan Manfaat asam amino pada sifat asam dan basanya.
Reaksi-reaksi pada Asam karboksilat
a. Rekasi dengan Basa (rekasi penyabunan/saponifikasi)
ketika senyawa asam karboksilat bereaksi dengan basa akan menghasilkan garam dan air. menurut rumus:
R-COOH + NaOH → R-COONa (sabun) + H2O
Rekai ini merupakan reaksi hidrolisis lemak/minyak (asam karboksilat) dengan menggunakan basa kuat dan dihasilkan gliserol dan garam asam lemak atau sering disebut sabun.
b. Reaksi Esterifikasi
Reaksi ini terjadi ketika asam ini di reaksikan dengan alkohol sehingga membentuk senyawa ester. Reaksinya merupakan reaksi kesetimbangan.
Contoh:
c. Reaksi Reduksi
Reaksi ini dilakukan dengan mereduksi asam karboksilat dengan menggunakan katalist lithium alumunium hidridda. Dari rekasi reduksi ini akan dihasilkan alkohol primer.
Contoh:
d. Reaksi dengan Amonia
Senyawa asam karboksilat jika direaksikan dengan senyawa amonia (NH3) akan menghasilkan senyawa amida dan hasil lain berupa air.
contoh:
e. Reaksi Dekarboksilasi
Asal sobat tahu, ketika berada pada suhu tinggi asam karboksilat akan kembali membentuk senyawa alkananya. Reaksi ini disebut derkaboksilasi.
Contoh:
f. Reaksi dengan Tionil Diklorida
Klorida asam (R-COCl), asam klorida (HCl), dan sulfur dioksida (SO2)dapat dihasilkan dari reaksi antara asam karboksilat dengan tionil diklorida (SOCl2).
contoh:
Manfaat Asam Karboksilat pada sifat asam dan basanya.
Kalau mau ditelisik satu-satu senyawa demi senyawa, banyak sekali manfaat asam karboksilat bagi kehidupan manusia. Berikut beberapa manfaat yang berhasil kami kumpulkan
a. Asam format atau yang dikenal juga dengan nama asam semut digunakan sebagai bahan baku pembasmi hama dan berperan besar dalam proses penggumpalan lateks.
b. Asam asetat– di dalam industri, asam asetat digunakan sebagai bahan baku sintesis serat dan juga plastik.
– digunakan sebagai pelarut dan pereaksi dalam laboratorium
– digunakan sebagai cuka makanan (kadar 3-6%)
c. Asam Oksalat– Ditemukan dalam daun bayam dan buah-buahan, bentuk senyawanya berupa garam natrium dan kalsium
– dapat digunakan untuk menghilangkan karat dan juga digunakan sebagai bahan baku pembuatan zat warna.
– mengasamkan minuman, permen, dan bahan makanan lainnya.
– sering digunakan dalam fotografi, keramik, dan proses penyamakan kulit.
d. Asam sitrat banyak digunakan sebagai bahan untuk pengawetan buah dalam kaleng.
e. Asam stearat merupakan salah satu bahan penting dalam pembuatan lilin.
Itulah tadi sobat materi dari kami tentang apa itu asam karboksilat, tatan namanya, sifat fisika-kimia, reaksinya, dan tak ketinggalan manfaatnya. Selamat belajar.
Manfaat asam benzoat yang pada sifat asam dan basanya.
Asam benzoat termasuk dalam kategori asam lemah, yang biasa digunakan sebagai pengawet makanan.
Selain itu, asam ini juga merupakan prekursor (bahan awal) yang penting dalam sintesis berbagai bahan-bahan kimia lainnya.
Asam ini secara alami terdapat dalam rempah-rempah seperti cengkeh dan kayu manis.
Proses pengawetan oleh asam benzoat
Mekanisme kerja asam benzoat atau garamnya didasarkan pada tingkat permeabilitas membran sel mikroba terhadap molekul-molekul asam.
Pada mulanya, sel mikroba mempunyai pH yang netral, lalu asam benzoat dapat menembus membran sel sehingga membuat pH di dalam sel mikroba menjadi lebih asam.
Kondisi asam ini mengakibatkan gangguan pada organ-organ sel sehingga metabolisme terhambat dan akhirnya sel mati.
Asam amino merupakan unit pembangun protein yang dibuat melalui ikatan peptida pada setiap ujungnya. Protein tersusun dari atom C, H, O, dan N, serta kadang-kadang P dan S. Dari keseluruhan asam amino yang terdapat di alam hanya 20 asam amino yang biasa dijumpai pada protein.
Dari struktur umum, asam amino memiliki dua gugus pada setiap molekulnya, yaitu gugus amino dan gugus karboksil, yang disusun sebagai struktur ion dipolar. Gugus amino dan gugus karboksil pada asam amino menunjukkan sifat-sifat spesifiknya. Karena asam amino mengandung gugus kedua, senyawa ini akan memberikan reaksi kimia yang mencirikan gugus-gugusnya. Sebagai contoh adalah reaksi asetilasi dan esterifikasi. Asam amino juga mengandung amfoter, yaitu dapat bereaksi sebagai asam dan memberikan proton kepada basa kuat, atau dapat memberikan efek basa dan menerima proton dari basa kuat.
Asam Amino esensial yang tidakdiproduksi oleh tubuh, antara lain sebagai berikut:
- Triptofan merupakan asam amino esensial, ini merupakan beberapa sumber di dapatkan dari karbonhidrat.Triptofan ada pada telur, daging, susu skim, pisang, susu, dan keju.
- Treonin ada di bahan makanan terdiri dari susu, daging, ikan, dan bici wijen.
- Metionin aktif esencial. Oleh karena itu, harus diambil dari bahan makanan. Sumber utama metionin hádala buah-buahan, daging (ayam, sapi, ikan, susu, beberapa jenis keju), saturan (bayam, bawang putih, jagung), serta kacang-kacangan (kapri, pistacio, kacang mete, kacang merah, kacang merah , tahu tempe).
- Lisin Ada dalam protein kedelai, bici polong-polongan, dan ikan. Rata-rata kebutuhan lisin per hari adalah 1-1,5 g.
- Leusin banyak tersedia pada makanan yang tinggi protein, seperti daging, susu, beras merah dan kacang kedelai. Pada produk-produk susu kedelai juga banyak di temui kandungan leusin.
- Isoleusin ;satu dari asam amino penyusun protein yang dikode oleh DNA. Rumus kimianya sama dengan leusin tapi susunan atom-atomnya berbeda. Ini berakibat pada sifat yang berbeda. Isoleusina berbahayahidrofobik (tidak larut dalam udara) dan esensial bagi manusia.Bagaimana pun juga, berdasarkan stereoisomer seperti treonin, isoleusina alam hanya tersedia dalam satu bentuk saja (lihat boks).
- Fenilalanin merupakan asm amino esensial yang menjadi bahan baku bagi pembentukan katekolamin.Katekolamin ini di kenal sebagai peningkat kewaspadaan penting bagi tranmisi impuls saraf. Ada pada daging ayam, sapai, ikan, telur, dan kedelai.
- Valin Ada pada produk-produk peternakan seperti daging, telar, susu dan keju. Selain itu, asam amino esensial ini terdapat pada bici-bijian yang mengandung minyak seperti kacang tanah, wijen, dan gentil).
Asam Amino non-esensial yang dipersembahkan oleh tubuh di antara yang lain:
- Tirosin ; pertama kali menemukan dalam keju. Pada manusia, asam amino ini tidak dapat diubah, tetapi pembentukanya menggunakan bahan baku fenilalanin oleh enzimphehidroksilase . Menurut penelitian yang dilakukan oleh institut penelitian kesehatan Lingkungan Amerika Serikat tahun 1988, tirosin bekerja pula sebagia obat stimulan dan penenang yang efektif untuk meningkatkan kinerja mental dan fisik di bawah tekanan, tanpa efek samping.Tirosin terkandung dalam hati ayam, keju, alpukat, pisang, ragi, ikan dan daging.
- Sistein ; Selain asam amino, tidak esensial mengandung atom sistein hampir sama dengan metionin. Sistein juga menemukan bahan makanan seperti cabai, bawang putih, bawang bombai, brokoli, haver, dan inti bulis gandum.
- Serin ; pertama kali di isolasi dari protein serat sutra pada tahun 1865.
- Prolin ; fungsi terpentingnya adalah komponen protein.
- Glisin ; Oleh umu, protein itu sendiri tidak mengandung glisin (kecuali kolagen yang mengandung glisin dari dua per tiga kandungannya). Tubuh manusia memproduksi glisin dalam jumlah yang mencukupi.
- Asam glutamat ; karena ion glutamat yang dapat membantu beberapa jenis saraf yang ada pada lidah manusia, glutamat di manfaatkan dalam industri penyedap rasa. Dalam keseharian di dapati dalam bentuk garam turunan yang disebut sebagai monosodium glutamat atau MSG.
- Asam aspartat ; sering pula di sebut aspartat. Fungsinya di bantu sebagia pembangkit neurotransmiter di otak dan saraf otot. Aspartat juga berperan dalam daya tahan terhadap kepenatan.
- Ariginin; Selain itu, non-esensial bagi manusia dan mamalia lain, tetapi ariginin dapat di katakan sebagai asam amino setengah esensial karena produksinya sangat tergantung pada tingkat perkembangan dan kondisi kesehatan. Pada anak-anak, ariginin dibahas penting. Pangan sumber utama ariginin ditemukan pada produk-produk peternakan seperti daging, susu, telur, dan berbagai olahannya. Sementara dari produk tumbuhan, ariginin banyak ditemukan di cokelat dan biji kacang tanah.
- Alanin ; ditemukan dalam bahan makanan bentuk lain seperti daging, ikan, susu, telur, dan kacang-kacangan.
- Histidin ; Bagi manusia, histidin merupakan asam amino yang penting bagi anak-anak.
- Glutamin; merupakan asam amino yang dikenal pula dengan sebutan asam glumatik. Asam amino ini berfungsi sebagai bahan bakar otak yang mengendalikan kelebihan amonia yang terbentuk dalam tubuh akibat proses biokimia. Secara alami, glutamin ditemukan dalam gandum dan kedelai.
- Asparagin ; di minta oleh sistem saraf untuk meminta kesetimbangan dan di minta pula dalam mengubah asam amino. Asparagin di temukan pula pada daging (segala macam sumber), telur dan susu (serta produk turunanya).
Permasalahan:
1.
Pada gambar diatas yaitu struktur asam
etanoat, asam-2- kloroetanoat dan asam-2-hidroksietanoat dari ketiga struktur
tersebut coba anda jelaskan dan urutkan kekuatan asam yang lebih tinggi pada
struktur yang mana serta berika alasannya karna dapat kita lihat struktur
diatas sama sama dari asam karboksilat
2.
Jika kita bandingkan fenol bersifat asam lemah
jika dibandingkan dengan asam karboksilat tetapi mengapa fenol lebih asam dari
pada sikloheksanol, berikan penjelasan anda dilihat juga dari kesetabilan
resonansinya?
3.
Kita ketahui bahwa efek induksi sangat
mempengaruhi terhadap keasaman senyawa, yang ingin saya tanyakan pada efek
induksi apakah perbedaan jumlah CH3 akan mempengaruhi keasaman,berikan alasan
anda?










no.3
BalasHapusEfek induktif itu merupakan efek elektronik yang ditransmisikan melalui ikatan pada gugus yang dapat berupa dorongan elektron atau penarikan elektron. tergantung apa yang terikatan pada spesi itu. Efek induktif melemah ketika jarak dari kelompok meningkat. Kasus pada ikatan CH3–CH2F, elektron akan ditarik lebih kuat ke F sehingga bila sampai lepas maka akan menghasilkan CH3–CH2+ yang lebih bersifat asam.
2. Fenol lebih asam dibandingkan sikliheksanol karena pada fenol terjadi resonansi karena adanya gugus benzen, disini gugus benzene bertindak sebagai gugus penrik elektron sehingga atom O dari gugus OH akan bermuatan positif dan proton mudah dilepaskan. sedangkan pada sikloheksanol tidak terjadi resonansi.
BalasHapus1.menurut saya urutannya adalah asam 2-kloroetanoat > asam 2-hidroksietanoat > asam etanoat. Alasannya adalah memang mereka berasal dari sama-sama asam karboksilat, tetapi terlihat pada struktur masing² terdapat substituen keelektronegatifan yang berbeda. Dimana berdasarkan efek induktif relatif didapat urutan Cl > OH > H.
BalasHapus